Rumus-Rumus Fisika Lengkap/Teori kinetik gas
Dari Wikibooks Indonesia, sumber buku teks bebas berbahasa Indonesia
Daftar isi[sembunyikan] |
[sunting]Mol dan massa molekul
1 mol= 6,022 x 1023 molekul
6,022 x 1023 juga disebut dengan bilangan avogadro (NA).
Massa sebuah atom/molekul: 

Hubungan antara massa dengan mol: 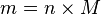 atau
atau 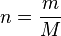
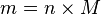 atau
atau 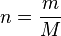
Keterangan:
- n: jumlah mol
- M: Massa relatif atom/molekul
- m: massa zat (kg)
[sunting]Persamaan keadaan gas ideal
[sunting]Hukum Boyle
Tekanan gas akan berbanding terbalik dengan volumenya pada ruangan tertutup.
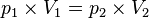
[sunting]Hukum Charles Gay-Lussac
Volume benda akan berbanding lurus dengan suhu mutlaknya pada ruangan tertutup.

Dari kedua hukum diatas, maka:
 atau disebut dengan Hukum Boyle-Gay Lussac.
atau disebut dengan Hukum Boyle-Gay Lussac.[sunting]Persamaan gas ideal

Keterangan:
- p: tekanan
- v: volume ruang
- n: jumlah mol gas
- R: tetapan umum gas
- T: suhu (Kelvin)
Perhatikan satuan:
- R= 8314 J/kmol K apabila tekanan dalam Pa atau N/m2, volume dalam m3, dan jumlah mol dalam kmol
- R= 0,082 L atm/mol K apabila tekanan dalam atm, volume dalam liter, dan jumlah mol dalam mol
[sunting]Turunan dari persamaan gas ideal
Karena 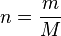 maka dapat dituliskan:
maka dapat dituliskan:
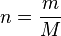 maka dapat dituliskan:
maka dapat dituliskan:

Karena
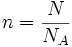 , maka akan didapat persamaan:
, maka akan didapat persamaan: (dari rumus P V = n R T)
(dari rumus P V = n R T)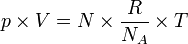
 , maka:
, maka: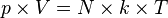
k disebut dengan tetapan Boltzmann, yang nilainya adalah:

Tidak ada komentar:
Posting Komentar